悪性腹膜中皮腫(Diffuse malignant peritoneal mesothelioma)について
公開日:2022年9月16日
本論文は「Journal of Cancer Metastasis and Treatment」(出版元:OAE Publishing Inc.)で掲載予定の論文を翻訳したものです。
中皮腫において標準治療があるのは、「胸膜中皮腫」のみです。腹膜・心膜・精巣漿膜の中皮腫については、標準治療も診療ガイドラインもありません。したがって、腹膜中皮腫と診断された患者さんやご家族は診療してくれる病院を探すことから難渋し、さらに治療選択でも難しい判断を迫られている状況があります。
そのような中、本論文は今後の患者さんやご家族のみなさまの治療選択のための参考としてご活用頂けると考えています。主治医との相談の材料として頂くなど、患者の皆様が悔いのない治療選択をしていただく一助として本論文が寄与されるものと期待しています。他方で、「ONO-4538 第Ⅱ相試験 悪性中皮腫(胸膜を除く) を対象とした多施設共同非盲検非対照試験」などの胸膜中皮腫以外の患者が対象となったオプジーボ(ニボルマブ)単剤の臨床試験結果の公表も待たれる状況があります。
セカンドオピニオンなどを活用して、複数の経験豊富な専門医から意見を聞き、治療選択をして頂くことが望ましいと考えられます。
メッセージ:岡部和倫(ベルランド総合病院呼吸器外科部長)
略語一覧
CCR-0 遺残腫瘍のない完全切除
CCR-1 遺残腫瘍の直径が5mm以下
CCR-2 遺残腫瘍が5mmから5cm
CCR-3 遺残腫瘍が5cm以上
CDDP シスプラチン
CRS 減量手術 ※肉眼的完全切除 aggressive cytoreductive surgery
DMPM びまん性悪性腹膜中皮腫
EPIC 術後早期腹腔内化学療法
HIPEC 腹腔内温熱化学療法
LHIPEC 腹腔鏡下HIPEC
MCPM 多嚢性腹膜中皮腫
MST 生存期間中央値
NIPEC 非加熱術中化学療法
NIPS 術前腹腔内/全身化学療法
PCI peritoneal cancer index 腹膜播種係数
Performance Status パフォーマンスステータス。患者の全身状態における日常生活の制限の程度を示す指標。
POC 周術期化学療法
PSM 腹膜播種
SC 全身化学療法
WDPPM 高分化型乳頭状腹膜中皮腫
論文:悪性腹膜中皮腫(Diffuse malignant peritoneal mesothelioma)について
英語論文執筆者:米村 豊(岸和田徳洲会病院 腹膜播種センター 播種性転移研究会)
翻訳:勝谷禎介(播種性転移研究会 腹膜播種専門コーディネーター)
Yutaka Yonemura1,2,3*, Haruaki Ishibashi2, Akiyoshi, Mizumoto3, Takuji Fujita2, Yang Liu2,, Satoshi Wakama2, Syouzou Sako2, Nobuyuki Takao3, Toshiyuki Kitai2, Kanji Katayama2, Yasuyuki Kamada2, Keizou Taniguchi4, Daisuke Fujimoto4
1 Asian School of Peritoneal Surface Malignancy Treatment, Kyoto City, Kyoto Prefecture, Japan, 600-8189.
2 Department of Regional Cancer Therapy, Peritoneal Dissemination Center, Kishiwada Tokushukai Hospital, Kishiwada City, Oosaka Prefecture, Japan, 596-8522.
3 Department of Regional Cancer Therapy, Peritoneal Dissemination Center, Kusatsu General Hospital, Kusatsu City, Shiga Prefecture, Japan, 525-8585n.
4 Department of Surgery, Mizonokuchi Hospital, Teikyo University, School of medicine, Kawasaki, Kanagawa, 213-8507, Japan.
*Correspondence to: Yutaka Yonemura, MD., PhD, Representative of Asian School of Peritoneal Surface Malignancy Treatment. Department of Regional Cancer Therapies, Peritoneal Surface Malignancy Treatment Center, Kishiwada Tokushukai Hospital, Osaka,
キー ワード: 腹膜中皮腫、中皮腫、腹腔内化学療法、HIPEC、腹膜切除術
要旨
悪性腹膜中皮腫(DMPM)に関する論文をレビューし、治療法が、奏効率、治療後の副作用、罹患率と死亡率、生存率に及ぼす影響を分析した。
全身化学療法後の生存期間中央値(MST)は、8.7カ月から26.8カ月だった。しかし、全身化学療法単独で5年以上生存した患者は報告されていない。
一方、手術(CRS)+周術期化学療法(POC)を含む包括的治療では、全身化学療法単独に比べ、MSTが有意に延長したことが判明した。さらに、CRS+POC は10年生存率が12%から35%であることが示された。 従って、CRS+POC は、条件を満たして選ばれたDMPM患者において長期生存を可能にする革新的な治療法である。選択基準は、Performance Status(ECOG PS≦1)、腹膜外転移の有無、PCIがカットオフ値以下(<10 ~<28)、MIB-1 index(10%以下)、組織型(epithelioid type)である。
CRS後の術後合併症率と死亡率は、一般的な手術に比べ有意に高かった。従って、CRSとPOCは腹膜播種専門施設で行うべきである。
はじめに
悪性腹膜中皮腫(DMPM)は、中皮細胞から発生する悪性腫瘍で、腹膜表面にびまん性に増殖するまれな腹膜悪性腫瘍である。DMPMの発症要因として、アスベスト、SV40ウイルス、慢性腹膜炎が関与しているとされている【1,2】。また、DMPMと診断された患者の約 33%から 50%は、過去にアスベストへの暴露があったことが報告されている【3,4,5,6】。
DMPM は、胸膜中皮腫と比較して、男女比が低く、平均死亡年齢も低い【4,5】。DMPMの年齢標準化罹患率は、一般に人口 100 万人あたり0.5~3例【6】で、男女比は 1.6:1【5】である。
最も高いのは英国、オーストラリア、ニュージーランドで、最も低いのは日本【7,8】と報告されている。
アスベストの使用が法律で禁止された現在、DMPMによる死亡者数は減少すると予想されている【7】。しかし、米国だけでも 2005 年から2050年の間に約 15,000 人の DMPMが新たに診断されると推定されている【7】。 従来の分類では、DMPM、多嚢性腹膜中皮腫(MCPM)、高分化型乳頭状腹膜中皮腫(WDPPM)の3つに分類されている【8】。MCPM は悪性度が低く予後良好、WDPPM は腹膜下組織に浸潤しない傾向があり、増殖活性も弱いため DMPM より悪性度が低いとされている【9】。
一方、DMPM は、浸潤能やリンパ節転移能が高いため、従来は急速に致死する疾患とみなされてきた。また、日本で一般的に用いられている全身化学療法は、DMPM 患者の長期生存率を改善できない。
近年、外科治療と腹腔内温熱化学療法(HIPEC)の併用が、生存率と治癒率を向上させる可能性のある有望な治療法として注目されている【10】。
この論文の目的は、DMPM および WDPPM 患者に対するCRSとHIPECを用いた局所治療の有効性と治療法の選択基準の両方を検討することだ。
1)DMPM の治療法
全身化学療法(SC)、CRS、CRSと周術期化学療法(POC)の併用(Neoadjuvant systemic chemotherapy(NASC) 含む)、腹腔鏡下術前HIPEC、術中HIPEC など、いくつかの治療方法が報告されている。術前腹腔内/全身化学療法(NIPS)、腹腔鏡下術前HIPEC、術中HIPEC、術後早期腹腔内化学療法(EPIC)、非加熱術中化学療法 (NIPEC)【9,11】など、CRSと周術期化学療法(POC)の併用が挙げられる。これらの治療の中で、術前腹 膜播種係数(PCI)≦19のDMPM患者の生存率を改善する最も有効な治療法として、POCとCRS を組み合わせた包括的治療が注目を集めている【9】。しかし、これまで POC を併用した手術療法を評価した無作為化第 III 相試験は行われていない。
手術適応のないDMPM症例では、SCが標準的な治療法である(Table 1)【12,13,14】。
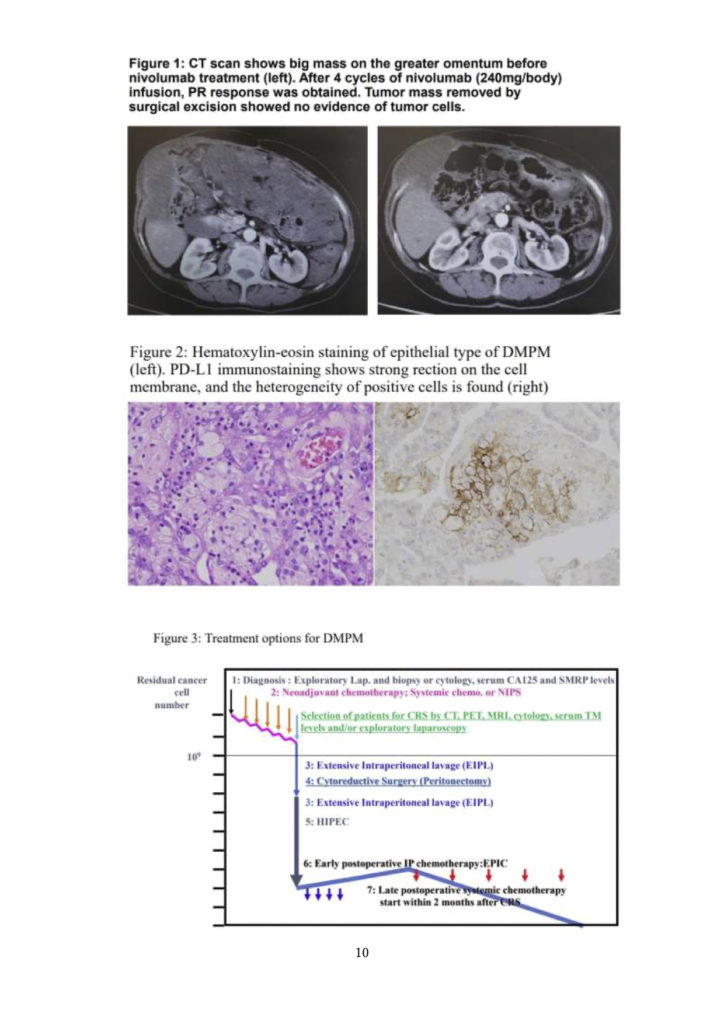
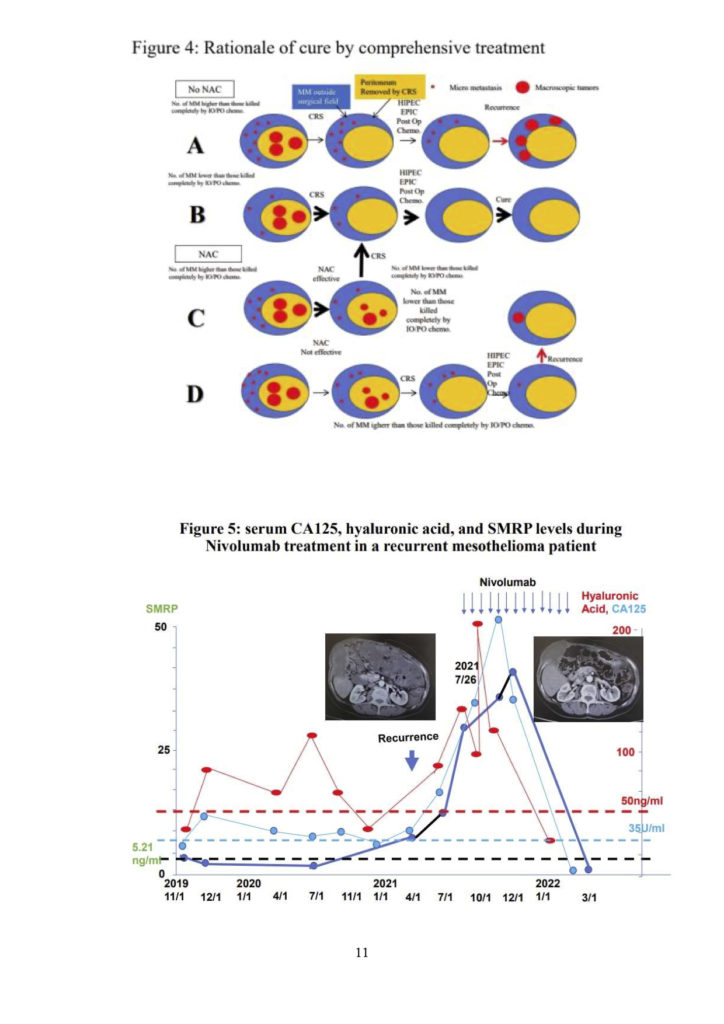
Cartenni Gらは、ペメトレキセド(アリムタ)とシスプラチン(CDDP)を用いた治療とアリムタ単剤を用いた治療の結果を報告した【12,13】。アリムタ+CDDP 群はアリムタ単独群に比べ、奏効率および全生存率が有意に優れている。Simon GR が、ゲムシタビン+アリムタの効果を検討し、アリムタ+CDDP より優れた奏効率 と生存率を示した【14】。しかし、このプロトコルはグレード 3、4 の副作用が著しく多く、グレード5も1 件あった。そのため、国際的にはアリムタ+CDDP の併用療法がベストレジメンとされ、ゲムシタビンとアリムタが second-choice として提案されている【12,13,14】。現在、アリムタ+CDDP の併用療法は、DMPM に対する標準的な第一選択の全身化学療法として受け入れられている。これらの治療による全生存期間の中央値は 8.7~ 26.8 カ月【12,13,14】であり、5年以上生存している例はほとんどない【12,13,14,15】。最近、Sgarburaらは、DMPMの第一選択治療として、PIPACとSCの併用とSC単独の生存率への影響を評価する第 II 相多施設共同無作為化試験を開始した【16】。しかし、その結果は未だ報告されていない。最近、2021年にFennelらによりニボルマブを用いた革新的な治療が報告された【17】。彼らは、中皮腫患者【17】316 人(95.2%)、胸膜中皮腫と非胸膜中皮腫の患者16人に対する二重盲検無作為化第 III 相試験の結果を報告した。PD-L1の組織発現は、ニボルマブ群 27%、プラセボ群 23%で陽性であった。最も頻度の高いグレード3以上の治療関連有害事象は、ニボルマブ群 221 例中 6 例(3%)に対してプラセボ群 2 例(2%)の下痢で、両群とも治療関連死亡はなかった。また、奏効率はニボルマブ群 11%、プラセボ群 1%であった。さらに、治療群とプラセボ群の生存期間中央値(MST) はそれぞれ10.2カ月と6.9カ月で、ニボルマブ群の全生存期間はプラセボ群に比べ有意に良好であった(HR 0.69) 【17】。fig.1のCTスキャンは、ニボルマブ投与前の上皮型腹膜中皮腫の患者の大網に大きな腫瘤があることを示しています。ニボルマブ(240mg/dose)点滴4サイクル後、PR奏効が得られた。また、外科的切除により摘出された皮下残存腫瘍塊には、腫瘍細胞は認められませんでした。これらの結果は、ニボルマブが DMPM 患者に対して有効である可能性を示唆している。Whiteは、PD-L1発現は不均一であり、化学療法後に発現が変化することを指摘している【18】。fig.2 は、上皮型 DMPM の PD-L1 発現を示したものです。PD-L1は細胞膜に発現しているが、その発現は通常不均一である。この観察は、DMPMに免疫チェックポイント阻害剤を開始する際に念頭に置く必要がある。
2)腹膜転移患者を治癒させるための包括的治療の治療理論的根拠
腹膜播種(PSM)患者は、手術単独でも化学療法単独でも治癒させることはできない。
手術単独で治療されたPSM患者は、肉眼的転移を完全に切除しても、腹膜表面に残された微小転移が増殖するため死亡する【19】。全身化学療法を行うと、化学療法感受性癌細胞は死滅するが、初めから混在する多剤耐性がん細胞が増殖し、再発する。また、化学療法を数回繰り返すと、重篤な副作用が出現し、化学療法を中止せざるを得なくなる。この2つの要因により、化学療法は失敗に終わっている。
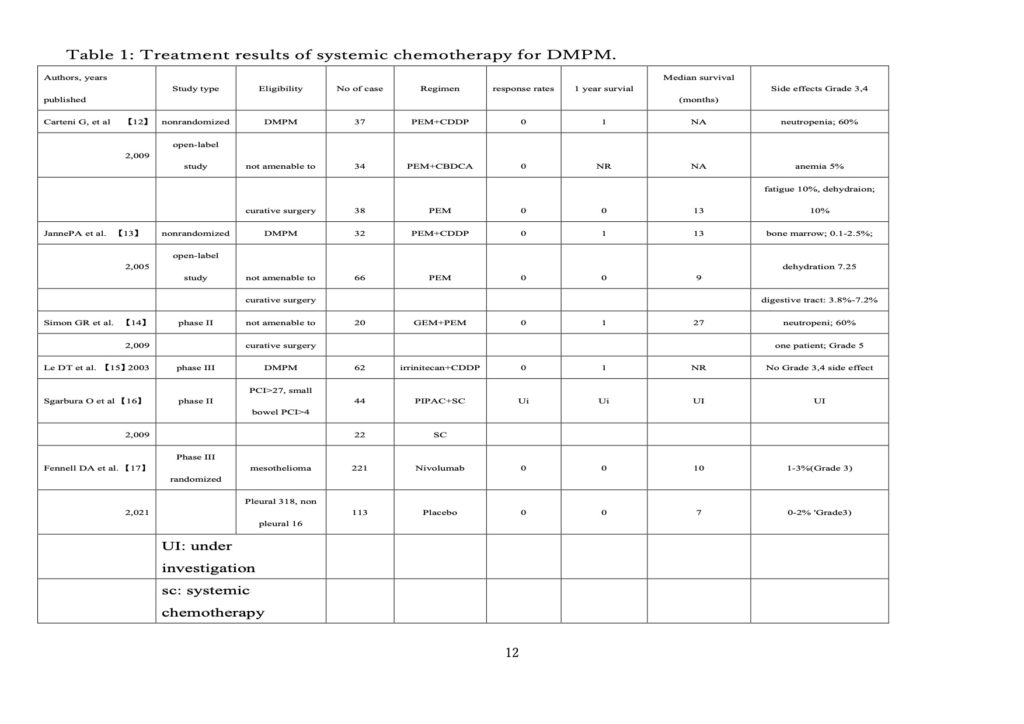
2000年、国際腹膜播種腫瘍機構(PSOGI)は、PSM 患者を治癒させる可能性のある包括的治療法を提案した。包括的治療とは、CRSによる肉眼的腫瘍の完全切除と、CRS 後に残った微小転移をPOCで除去することである。使用される治療法は疾患によって異なる。DMPMでは、術前化学療法(NASC、NIPS、腹腔鏡下術前HIPEC)、CRS、術中腹腔内洗浄、術中 HIPEC、術後早期腹腔内化学療法(EPIC)、術後後期全身化学療法(fig.3) 【19】など7つの選択肢が用いられてきた。fig.4は、PSMの包括的治療による治癒の理論的根拠を示したものである。
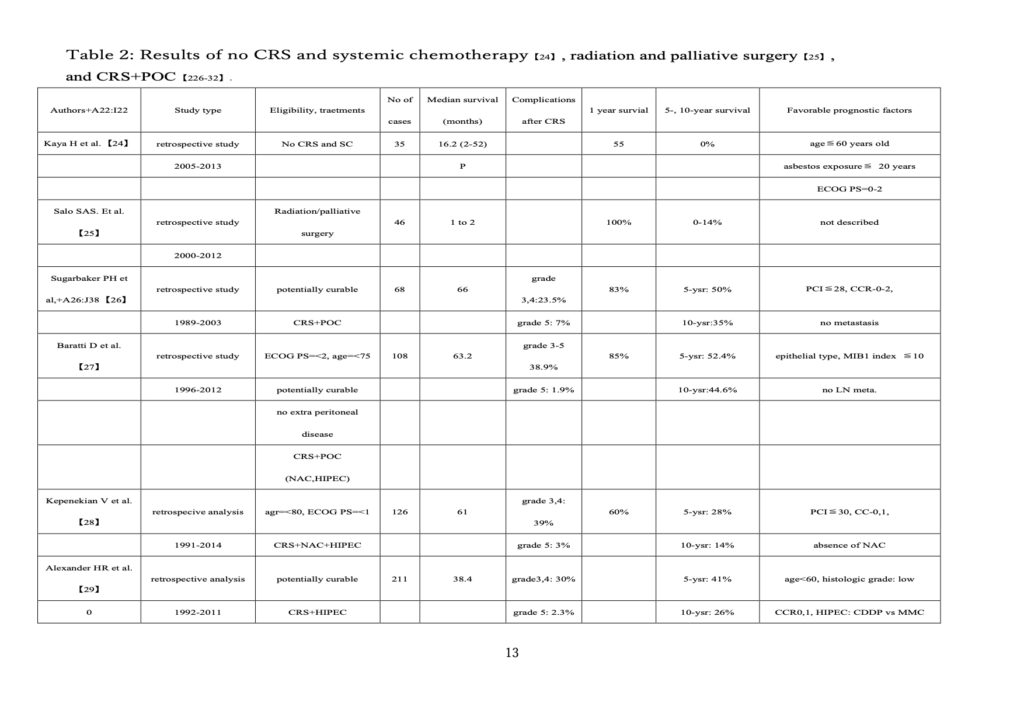
Aコースでは、CRS+HIPEC後、術中HIPEC、EPIC、術後化学療法(CRS 後化学療法:POCC)で遺残癌細胞を完全消滅できる量以上の遺残癌細胞があるため全例死亡する。しかし、Bコース(fig.4)では、CRS 後に残った微小転移が POCC で完全消滅できる数以下であり、患者は治癒する。Cコースでは、CRS後の微小転移巣の残存数がPOCCで完全に除去できる数を超えているため患者は再発で死亡することになる。しかし、NASCやNIPSによって微小転移がPOCCで完全に除去できる閾値以下になると、POCC で治癒させることだ できる(fig.4、C コース)。一方、NASCやNIPSが遺残腫瘍を十分に減少できない場合、患者は再発で死亡する(fig.4、D コース)。fig.3 に示すように、CRS 直後が最も残存がん細胞量が少なく、PSM患者の治癒にはCRS 直後に行う術中HIPECが重要な役割を担っており、PSM患者を治癒させるためには、BコースやCコースに誘導する必要がある。
3)診断とCRSの意思決定
DMPM患者の治療選択は、さまざま職種で構成される集学的治療チームによる決定が必要である【9】。病変の広がりは、PET(positron emission tomography)、CT(computed tomography)により診断する必要がある【9】。
PET は感度、特異度、正確度がそれぞれ 86%、89%、87%であり、有望なツールと考えられている【20】。
腹腔鏡検査は、PCIの正確な診断、組織診断、切除可能性の評価において重要な役割を担っている。Laterzaらは腹腔鏡検査が CRS の患者選択において重要なツールであると報告しており【21】、感度、特異度、陽性適中率、陰性適中率、正確度はそれぞれ 100%、75%、97%、100%、97%であったと報告している。また、腹腔鏡検査では、同時に腹腔内温熱化学療法(HIPEC)もできる。
Baratti らは、腫瘍マーカー値の臨床的有用性を評価した【22】。
CA125、CEA、CA19-9、CA15-2 の診断感度は、それぞれ 53%、0%、4%、49%であった。
術後の CA125 値が正常範囲内であることは、完全な癌細胞減量を反映している【22】。従って、CA125 値は癌細胞減量と再発のマーカーとして使用する場合、重要な選択基準となる可能性がある(fig.5)。しかし、血中 CA125 は開腹しただけでも上昇するため、術後早期の判断には注意が必要である。
可溶性メソセリン関連ペプチド(SMRP)は、40kDa の糖タンパクの循環型であり、通常は中皮細胞上に存在するが末梢血中でも検出できる【23】。血清 SMRP 値は、感度、特異度、陽性・陰性予測値がそれぞれ 70%、100%、 100%、61%である。
血清SMRP値は、DMPMの診断のみならず、薬物療法後の反応を評価する貴重な指標として有用である(fig.5)。
4)DMPM の外科的治療
無治療のDMPM患者のMSTは、16.2 カ月(2~52カ月)で5年生存者はなく【24】、緩和手術や放射線治療のみの患者の予後はMST が1~2カ月と悲観的である【25】。
緩和的全身化学療法を受けたDMPM患者のMSTは、8.7~26.8 カ月【12-17】であり、さらに全身化学療法後の5年生存率は報告されていない。
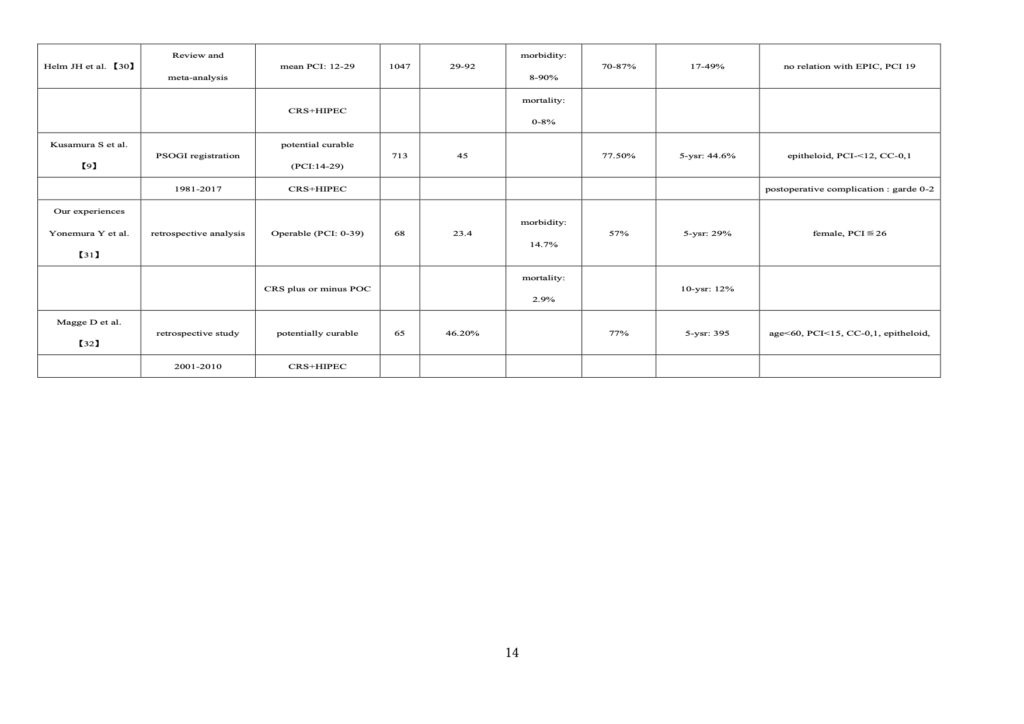
一方、CRS+術中HIPECは、PCIが低い一部のDMPM患者において有効な治療法と考えられており、そのMSTは 23.4~66 カ月、5 年生存率は 28~58%、10 年生存率は 12~39%【9、26~32】であった。多変量解析 では,PCIレベル、完全切除(CCR-0)、上皮細胞組織型、MIB-1 index 10%以下、術後合併症 grade 3、4 がな い例、年齢 60 歳以下、女性が独立した予後良好因子であった【26-32】(Table 2)。予後を良好にするための選択基準のPCIカットオフ値は 12 から 28 以下の範囲と報告されている。
DMPM の組織学的分類は、上皮型、肉腫型、二相型からなる。上皮型は二相型や肉腫型に比べ、有意に予後 が良好である。肉腫型中皮腫はDMPM全体の4%(15/248)であり【33】、予後は非常に悪く、診断からMSTは5ヵ月である。また、化学療法に対する反応性が非常に悪く、臓器浸潤もよく見られる。
肉眼的完全切除(CCR-0)は、有意に予後を改善する因子である【9,26,28,29,32】。CCR-0切除率は、37%~ 60%であり、CRSの選択基準により異なる。我々は 84 例のDMPM と8例のWDPPMを経験し、68 例(74%) にCRSが施行された。CCR-0切除を実施できたのは、わずか 25 例(37%)であった。肉眼的腫瘍遺残切除(CCR-1) の主な理由は、PCI 高値、小腸腸間膜のびまん性浸潤(SB-PCI 高値)、横隔膜または腹筋への直接浸潤であった。CCR-0とCCR-1のSB-PCIレベルはそれぞれ 2.9 ± 3.4 (0 から8までの範囲)と8.0±4.2 (0から12まで) (P<0.0001) であった。したがって、NACによるPCIとSB-PCIの減少は、CCR-0の率を高め術後生存率を改善するために不可欠である。
5)NASC、術前腹腔鏡下HIPEC、NIPSの効果
アリムタ+CDDP、ゲムシタビン+CDDP、ニボルマブ療法などの全身化学療法は、11%~24%の奏効率を示した【12-17】。現在、DMPM患者における標準化学療法は、pemetrexed(アリムタ)ベースのレジメンとみなされている【28】。しかし、Kepenekianらは、アリムタ+CDDPによるNASC 後にCRS+HIPECを行った患者の5年生存率は 40%で、CRS+術後化学療法、CRS+術前術後化学療法、CRS+HIPECは、それぞれ 67%、62%、 56%で不良であったとしている【28】。彼らは、多くの NASC 患者が既に予後不良因子を持っていると想定している【28】。Naffoujeらは、アリムタ+CDDPによる全身化学療法は、1 年後の短期的な生存率改善をもたらすが、この時点以降の生存率を改善しないと報告している【12-17】。一方、Deracoらは、ECOGパフォーマンスステータスが0、PCI<20のDMPM患者116人を対象に、アリムタ+CDDPを用いた周術期全身化学療法の役割についても検討した。彼らは、術前化学療法を行った群、術後化学療法を行った群、周術期化学療法を行わなかった群の間で、生存率に有意差はなかったと報告している【35】。CRS+HIPEC 後の術前全身化学療法の有用性は不明である【9】とKusamuraSは主張している。DMPM患者におけるNASCの役割を検証するためには、prospective randomized trialが必須である。
CRS+HIPECは、全身化学療法単独と比較して、現在DMPM患者【9】に対する最も有効な治療法であると考えられている。43°C以上の高温は、細胞タンパク質の3次元構造に不可逆的な変化をもたらし、43.5°Cの高温 を 60 分続けると 99%の細胞が死滅する。米村は、胃癌の腹膜転移に対する腹腔鏡下HIPEC(LHIPEC)の効果について研究した【37】。腹腔鏡で腹膜表面を観察しPCIを決定した後、ドセタキセルとシスプラチン各 40mg を含む 43~43.5°Cの生理食塩水 4000ml で腹腔を60分灌流する。LHIPECの1サイクル後、PCIは1.85有意に減少した(7.68 ± 8.48 から 5.38 ± 8.47, P=0.038, N=55)。
同じ方法で治療した12人のDMPM患者の経験では、LHIPECの前と1ヵ月後のPCIの変化を調べ、LHIPECの1サイクルでPCIは、21.1±11.8から16.3±13.1へ減少した(P=0.033)。
WDPPM患者3名をLHIPEC単独で治療した。3例ともLHIPEC後10年、3年、4年経過して生存している。
WDPPMでは、中皮腫細胞は腹膜表面に単層でびまん性に増殖し、腹膜下組織への浸潤能は低い。従って、LHIPECはPCIが高値のWDPPMの治療に有効な方法であると考えられる。しかし、WDPPMの切除標本の多数の切片を精密に組織学的に検討すると、限局した腹膜領域に腹膜下浸潤を認めることがある。このような場合 には、CRS が推奨される。
現在では、PSM【37】に対する有効な治療法として術前腹腔内/全身化学療法(NIPS)が考えられている。NIPSでは、1日目と14日目にドセタキセルとCDDPの40mgを 500mlの生理食塩水で腹腔内投与し、1 日目から14日目までS1 60mg/m2を経口摂取開始する【37】。1 週間の休薬(15 日目から 21 日目まで)後、NIPS を少なくとも 3 サイクル繰り返す。
我々の 7 名のDMPM患者において、NIPSはPCIを28.1±9.8から18.1±7.4まで減少させた(P=0.008)。
術後早期腹腔内化学療法(EPIC)は、CRS 後の残存微小転移を除去するためにDMPM患者に使用されてき た。最近、Sugarbakerらは、CRS 後の上皮型 DMPM 患者 129 例を対象にEPIC(NIPEC)の生存率に対する有用性を検討し、EPIC 群は他の群に比べ有意に良好な生存率を示した【11】。
CRS+HIPECを施行したDMPM症例では、局所補助療法としてNIPECが推奨される【9】。
我々の経験では、CCR-0 切除は 31%(25/81)【31】、化学療法なし、NASC、NIPS 後の CCR-0 切除率は、 それぞれ 24%(5/21)、32%(9/28)、34%(11/32)であった。
不完全切除になる主な理由は、小腸の腸間膜と漿膜表面のびまん性病変である。Le Royらは、IPアリムタとIV シスプラチンまたはカルボプラチンを用いた二方向化学療法により、PCIが二方向化学療法前の 27(15 から39 の範囲)から14(15 から30の範囲)へ減少したことを報告した【42】。NASCは通常、患者を切除可能な状態に転換するのに十分なダウンステージを達成しないが、二方向性化学療法とNIPS+術前LHIPECは小腸間膜のPCIを著しく減少させ、結果としてCCR-0率を上昇させることができた。CRS+HIPEC は、PCI、年齢、 組織型などから選別されたDMPM患者に対する治癒を望める唯一の治療法として浮上しているが、CRS+HIPECは、grade 3/4の罹患率および死亡率がそれぞれ 8~90%と 1.9~8%と高い(Table 2)。従って、CRS+ HIPECは、Performance Status、PCI レベル、組織型、年齢によって患者を厳密に選択し(Table 2)、PSM 専門施設で限定して行うべきである。
6)今後の展望
上記のデータおよび結果は、レトロスペクティブな解析によるものである。しかし、NASC、NIPS、術後化学療法がCRS+HIPEC後の安全性、生存率にどのような効果をもたらすかは明らかにされていない。これらの選択肢の役割については、無作為化臨床試験で検証される必要がある。免疫療法のような最近の革新的な治療法は、DMPM患者の生存率を向上させるためのブレークスルーとなる可能性がある。また、DMPMに特異的な遺伝子産物に着目した新しい分子標的薬の開発が待たれる。
7)結論
50 例以上のDMPM患者を対象とした英文論文をPubMedから集め検討し、治療法の奏効率、治療後の副作用、罹患率と死亡率、生存率に対する有効性を分析した。アリムタとシスプラチン/ゲムシタビンを用いた全身化学療法によるMSTは、8.7%から26.8%であった。しかし、全身化学療法単独では長期生存者は報告されていない。一方、CRS+POCを併用した包括的治療では、全身化学療法単独に比べ有意に長いMSTを示した。また、CRS+POCでは、10年生存率が12%~35%であった。従って、CRS+POC は、選択されたDMPM患者を治癒させることができる革新的な治療法である。選択基準は、Performance Status(ECOG PS 1 以下)、腹腔外転移なし、PCIがカットオフ値以下、組織型(上皮型、epithelioid type)である。CRS 後、術後再発率および死亡率は、より通常の手術に比べ有意に高かった。従って、CRSとPOCは、腹膜播種専門施設で実施することが望ましい。
2.3.3.2 Authors Contributions
Writing: Yutaka Yonemura, Conceptualization: Haruaki Ishibashi, Akiyoshi, Mizumoto, Takuji Fujita, Format anlaysis: Yang Liu,, Satoshi Wakama, Data analysis: Syouzou Sako, Nobuyuki Takao, Toshiyuki Kitai, Kanji Katayama, Yasuyuki Kamada, Keizou Taniguchi, Daisuke Fujimoto. All authors have read and agreed to the published version of the manuscript.
2.3.3.3. Availability of Data and Materials
No applicable
2.3.3.4 Financial Support and Sponsorship
This research received no external funding.
2.3.3.5 Conflict of Interest
All authors declared that there is no conflict of interest.
2.3.3.6 Ethical approval and Consent to Participate
The study was approved by the ethical committee of Kishiwada Tokushukai hospital, the protocol; code of 19-35, that title is “A study of comprehensive treatment for peritoneal metastasis”. It was approved on 15, Onctober, 2007.
2.3.3.7 Consent for Publication
No applicable.
2.3.3.8 Copyright
Referrences
-
Mery E., Hommel-Fontaine J., Capovilia M., et al. Peritoneal malignant mesothelioma: review and
recent data. Ann Pathol 2014;34:26-33. 【DOI: 10/1016/j.annpat.2014.01.004】
-
Consonni D., Calvi C., De Matteis S., et al. Peritoneal mesothelioma and asbestos exposure: a population-based case-control study in Lombardy, Italy. Occup Environ Med 2019; 76: 545-553.
【DOI: 10.1136/oemed.2019.105820】
-
Bridda A., Padoan I., Mencarelli R., et al. Peritoneal mesothelioma.: a review. MedGenMed.
2007;9:32
-
Carbone M., Adsumolli PA., Alexander HR., et al. Mesothelioma: Scientific clues for prevention,
diagnosia and therapy. CA Cancer J Clin. 2019;69:402-429.
-
Delgermaa V., Takahasho K., Park EK., et al. Global mesothelioma deaths reported to the Wo;d
Health Organization between 1994 and 2008. Bull. World Health Organ. 2011;89:716-724.
-
Boffetta P. Epidemiology of peritoneal mesothelioma. A review. Ann Oncol. 2007;18:985-990.
-
Oddone E., Bollon J., Nava CR., et al. Forecast of malignant mesothelioma mortality in Italy up to
2040. Int J Environment Res Pub Health. 2021;18:160-194. 【DOI: 10.3390/ijerph18010160】
-
Moolgavkar SH., Meza R., Turim J. Pleural and peritoneal mesotheliomas in : age effects and
temporal trends. 2009;Cancer Causes Control.20:935-944.
-
Kusamura S., Kepenelian V., Villeneuve L., et al. Peritoneal mesothelioma: PSOGI/EURACAN
clinical practice guidelines for diagnosis, treatment and follow-up. Eur J Surg Oncol. 2021; 47: 36-8
-
Verwaal VJ., Kusamura S., Baratti D., et al. The eligibility for loco-regional treatment of peritoneal
surface malignancy. J Surg Onco. 2008;98:228-223
-
Sugarbaker PH., Chang D. Long-term regional chemotherapy for patients with epithelial malignant
peritoneal mesothelioma results in improved survival. Eur J Surg Oncol. 2017;43:1228-1235.
-
Cartenni G., Manegold C., Martin Garcia G., et al. Malignant peritoneal mesothelioma-Results from the international expanded access program using pemetrexed alone or in combination with a
platinum agent. Lung Cancer. 2009; 64:211-218.
-
Janne PA., Wozniak AJ., Belani CP., et al. Open-label study of pemetrexed alone or in combination
with cisplatin for the treatment of patients with peritoneal mesothelioma: outcoms of an expanded access program. Clinical Lung Cancer. 2005;7:40-46.
-
Simon GR., Verschraegen CF., Janne PA., et al. Pemetrexed plus gemcitabine as first line chemotherapy for patients with peritoneal mesothelioma: final report of a phase II tria;. J Cin Oncol. 2008;26:3567-3572.
-
Le DT., Deavers M., Hunt K., et al. Cisplatin and irrinotecan (CPT-11) for peritoneal mesothelioma. Cancer invest 2003;21: 682^689
-
Sgarbura O., Gourgou S., tosi D., et al. MESOTIP: Phase II multicenter randomized trial evaluating the association of PIPAC and systemic chemotherapy vs, systemic chemotherapy alone as 1st-line treatment of malignant peritoneal mesothelioma. Pleura and Peritoneum. 2019. Doi.org/10.1515/pp-2019-0010
-
Fennel DA., Ewings S., Ottensmeier C., et al Nivolumab versus placebo in patients with relapsed malignant mesothelioma (CONFIRM): a multicenter, double-blind, randomized, phase 3 trial. Lancet Oncol., 2021;22:1530-1540
-
White MG., Schulte JJ., Xue L., et al. Heterogeneity in PD-L1expression in malignant peritoneal mesothelioma with systemic oy intraperitoneal chemotherapy. Brit J Cancer. 2021;124:564-566
-
Yonemura Y., Reasons why systemic chemotherapy cannot cure patients with cancer. Pp138-139, Comprehensive treatment for peritoneal surface malignancy with an intent of cure., 2019, Ed By Yutaka Yonemura. Pub. By Japanese/Asian School of Peritoneal Surface Oncology.
-
Dubreuil J, Giammarite F., Rouset P., et al. The role of 18F-FDG-PET/ceCT in peritoneal mesothelioma. Nucl Med Commun 2017;38:312-318.
-
Laterza R., Kusamura S., Baratti D., et al. Role of explorative laparoscopy to evaluate optimal candicates for cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC) in patients with peritoneal mesothelioma. In Vivo. 2009;23:187-190
-
Baratti D., Kusamura S., Deraco M. Circulatinf CA125 and diffuse malignant peritoneal mesothelioma. Eur J Surg Onco;. 2009;35: 1198-1199.
-
Ramp A., Morikawa Y., Tanaka M., et al. Binding of ovarian cancer antigen CA125/MUC 16 to mesothelin mediated cell adhesion. J Biol Chem. 2004;279: 9190-9198.
-
Kaya H., Sezgi C., Tanrikulu AC., et al. Prognostic factors influencing survival in 35 patients with malignant peritoneal mesothelioma. Neoplam. 2014; 61,433-438. Doi:10.4149/neo_2014_053
-
Salo SAS., Ilonen I., Laarksonen S., et al/ Malignant peritoneal mesothelioma: treatment options and survival. Anticancer Res. 2019;39:839^845.
-
Sugarbaker PH., Welch LS., Mohamed F., et al. A review of peritoneal mesothelioma at Washington Cancer center. Sur. Oncol. Clin. North. Amer. 2003;12:605-662.
-
Baratti D.,Kusamura S., Cabras AD., et al. Diffuse malignant peritoneal mesothelioma: Long-term survival with complete cytoreductive surgery followed by nyperthermic intraperitoneal chemotherapy (HIPEC). Eur J Cancer. 2013;49:3140-3148
-
Kepenekian V., Elias D., Passot G., et al. Diffuse maliganat peritoneal mesothelioma: Evaluation od systemic chemotherapy with comprehensive treatment through the RENAPE database multi-institutional retrospective study. Euro J Cancer. 2016;65:69-79.
-
Alexander HR., Bartlet DB., Pingpank JF., et al. Treatment factors associated with lon-term survival after cytoreductive surgery snd regional chemotherapy for patients with malignant peritoneal mesothelioma. Surgery; 2013; 153:779-786.
-
Helm JH., Miura JT., Glenn JA., Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for malignant peritoneal mesothelioma: a systematic review and meta-analysis. Ann Surg Oncol. 2015;22:1686-1693.
-
Yonemura Y., Ishibashi H., Canbay E., et al. Treatment results of diffuse malignant peritoneal mesothelioma. Gan To KagakuRyoho; 2012;39:2416-2419
-
Magge D., Zenatti MS., Austin F., et al. Malignant peritoneal mesothelioma: Prognostic factors and oncologic outcome analysis. ANN Surg Oncol. 2014;21:1159-1165.
-
Pavlisko EN, Roggli VL. Sarcomatoid peritoneal mesothelioma. Clinicopathologic correlation of 13 cases. Am J Surg Pathol. 2015;11:1568-1575.
-
Naffouje S., Tufla KA., Salti GI. The impact of chemotherapy and its timing on survival in malignant peritoneal mesothelioma treated with complete debulking. Med Onco;. 2018;
-
Deraco M., Baratti D, Hutanu I., et al. The role of perioperative systemic chemotherapy in diffuse malignant peritoneal mesothelioma patients treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy。Ann Surg Oncol. 2013;20:1095-1100.
-
Lopock JR. Cellular effects of hyperthermia, relevance to the minimum dose for thermal damage. In J Hyperthermia. 2003;19:252-266.
-
Yonemura Y., Canbay E., Fujita T., et al. Effects of neoadjuvant laparoscopic hyperthermic intraperitoneal chemoperfusion and intraperitoneal/systemic chemotherapy on peritoneal metastasis from gastric cancer. J Peritoneum Other Serosal Surf. 2017;24:478-485.
-
Yonemura Y., Reasons why systemic chemotherapy cannot cure patients with cancer. Pp138-139, Comprehensive treatment for peritoneal surface malignancy with an intent of cure., 2019, Ed By Yutaka Yonemura. Pub. By Japanese/Asian School of Peritoneal Surface Oncology.
-
Yonemura Y., Reasons why systemic chemotherapy cannot cure patients with cancer. Pp166-167, Comprehensive treatment for peritoneal surface malignancy with an intent of cure., 2019, Ed By Yutaka Ynemura. Pub. By Japanese/Asian School of Peritoneal Surface Oncology.
-
Yonemura Y., Bandou E., Sawa T., et al. A new treatment by neoadjuvant intraperitoneal-systemic chemotherapy and peritonectomy for peritoneal dissemination from gastric cancer. Eur J Surg Oncol. 2006;32:661-665.
-
Yonemura Y., Ishibashi H., Mizumoto A., et al. The development of peritoneal metastasis from gastric cancer and rationale of treatment according to the mechanism. J Clin Med. 2022;11:458-482. Doi.org/10.3390/jcm11020458
-
Le Roy F., Gelli M., Hollebecque A., et al. Conversion to complete cytoreductionsurgery and hyperthermic intraperitoneal chemotherapy for malignant peritoneal mesothelioma after bidirectional chemotherapy. Ann Surg Oncol. 2017;24:3640-3646.